La adversidad en la infancia no es solo un capítulo difícil en la vida de una persona; es un factor determinante que moldea el cerebro, la salud y el bienestar a lo largo de los años. Numerosos estudios han demostrado que lo que vivimos en los primeros años de vida puede dejar una huella profunda, influenciando desde la estructura neuronal hasta la predisposición a enfermedades crónicas y las dinámicas de nuestras relaciones personales en la adultez.
¿Qué es la Adversidad en la Infancia?
Cuando hablamos de adversidad en la infancia, nos referimos a experiencias negativas que pueden marcar el desarrollo de un niño. Estas situaciones varían en gravedad e incluyen:
- Guerras y desastres naturales.
- Abuso físico o sexual.
- Desnutrición.
- Presencia de psicopatología en los padres o cuidadores.
- Maltrato, negligencia y relaciones afectivas distantes.
- Cuidado parental impredecible o desorganizado.


El entorno en el que crecemos moldea no solo nuestra personalidad, sino también nuestra biología. Aunque tradicionalmente se ha hablado de «parentalidad» en referencia a los padres, cualquier figura de crianza puede desempeñar este rol y ser clave en la construcción de un apego seguro o inseguro.
Efectos de la Adversidad Temprana en el Cerebro
Los primeros años de vida son una explosión de conexiones neuronales. El cerebro infantil es una esponja, pero también es frágil. La exposición temprana al estrés y la adversidad puede dejar marcas permanentes en su estructura y funcionamiento.
Investigaciones han demostrado que la adversidad infantil puede aumentar el riesgo de trastornos de ansiedad y depresión, deterioro cognitivo, trastornos de conducta, abuso de sustancias, menor resiliencia al estrés y mayor riesgo de suicidio (Heim & Nemeroff, 2001; Malave et al., 2022).
Cuando un niño vive en un ambiente de miedo e inseguridad, su cerebro aprende a sobrevivir, no a desarrollarse.
Impacto en la Salud Física: Más Allá del Cerebro
Los efectos de la adversidad infantil no solo alteran los sistemas neurobiológicos, resultando en un mayor riesgo de trastornos mentales. El cuerpo también lleva cicatrices invisibles. Se han encontrado fuertes asociaciones con enfermedades crónicas (Agorastos et al., 2018) como:
- Enfermedades cardiovasculares.
- Trastornos metabólicos y pulmonares.
- Dolor crónico y síndromes musculoesqueléticos.
- Enfermedades neurológicas y gastrointestinales
Estos hallazgos refuerzan la importancia de intervenciones tempranas para minimizar el impacto de la adversidad en la salud a largo plazo. No es solo una cuestión emocional; es un problema de salud pública.
Evidencia de los Efectos Intergeneracionales
Un experimento clásico con monos aislados en la infancia reveló un impacto devastador: al llegar a la adultez, eran socialmente inadaptados, condenados a la soledad o a la agresividad. Concretamente, las hembras que crecieron sin afecto se convirtieron en madres incapaces de brindar amor a sus propias crías. Este efecto intergeneracional de la privación materna nos habla de cómo el apego temprano impacta el comportamiento futuro (Dumas, 2022).
En otro estudio, se demostró que los bebés prematuros en incubadoras que no recibían contacto físico y emocional ganaban un 47% menos de peso que aquellos que eran acariciados y atendidos con afecto (ampliar detalles). El amor y el contacto físico son necesidades biológicas, no lujos.
La Importancia del Vínculo Temprano
Para contrarrestar estos efectos negativos, es fundamental fomentar el contacto físico y emocional entre niños y cuidadores desde el nacimiento. Estas interacciones son esenciales para un desarrollo cerebral saludable y una maduración emocional equilibrada.
Un abrazo, una palabra cariñosa, una mirada de aprobación pueden ser la diferencia entre un cerebro que aprende a confiar y uno que vive en alerta constante.
El Ambiente Provoca Cambios en la Descendencia
La ciencia ha demostrado que la adversidad infantil afecta la regulación del eje hipotalámico-pituitario-suprarrenal (HPA) y provoca cambios epigenéticos en genes clave como el receptor de glucocorticoides, NR3C1, encargado de la respuesta al estrés.
- En personas con antecedentes de abuso infantil, se ha observado una menor expresión de este gen en el hipocampo, perpetuando una respuesta exagerada al estrés (McGowan et al., 2009).
- Estudios han demostrado que la depresión en madres afecta la sensibilidad materna y aumenta el riesgo de problemas psicológicos en sus hijos. Pero, cuando la madre mejora, también lo hacen los niños (Pilowsky et al., 2008; Wickramaratne et al., 2011).
En la Fig. 1, se muestra cómo el gen NR3C1 influye en la respuesta del cuerpo al estrés, ayudando a entender cómo las experiencias adversas pueden dejar una huella a nivel biológico.
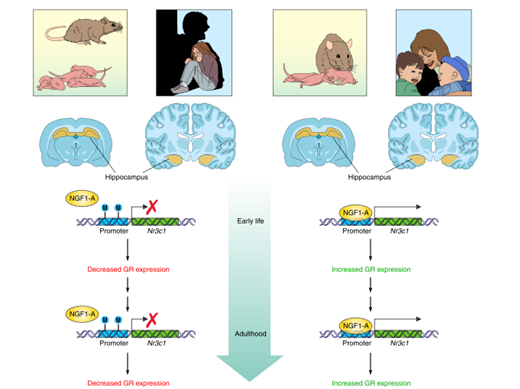
El esquema original está en inglés.
En la parte izquierda del diagrama se representa un escenario en el que las ratas experimentan aislamiento o ausencia de cuidado materno, y los humanos sufren abuso por parte de sus cuidadores. En estas condiciones, el estrés crónico y desproporcionado desencadena una disminución de la expresión del gen NR3C1 mediante metilación. Como resultado, las ratas privadas de cuidado materno tienden a replicar el mismo patrón con sus propias crías, reflejando un efecto intergeneracional similar al observado en el estudio con monos aislados.
Además, investigaciones han revelado que, en el hipocampo de víctimas de suicidio con antecedentes de abuso infantil, la expresión del gen NR3C1 también se encuentra reducida por metilación en comparación con los controles (víctimas de muerte súbita accidental sin antecedentes de abuso). Por el contrario, en víctimas de suicidio sin historial de abuso infantil, no se observaron diferencias en la expresión del gen respecto a los controles. Estos hallazgos proporcionan evidencia clave sobre los mecanismos epigenéticos implicados en la vulnerabilidad al estrés, aunque no descartan la existencia de vías alternativas (McGowan et al., 2009).
En contraste, en la parte derecha del esquema, se muestra el efecto de un alto nivel de cuidado materno en ratas—caracterizado por una mayor frecuencia de lamido, aseo y lactancia—y la ausencia de abuso en humanos. En este contexto, se observa una mayor expresión de NR3C1 en el hipocampo, lo que persiste en la adultez y se asocia con un comportamiento más equilibrado y adaptativo en las ratas.
Dado que el estudio en humanos se realizó en tejido postmortem, no fue posible evaluar directamente las consecuencias conductuales. Sin embargo, la convergencia de estos hallazgos sugiere un mecanismo común en el que el cuidado parental influye directamente en la regulación epigenética de la expresión de NR3C1 en el hipocampo, impactando la respuesta al estrés a lo largo de la vida.
Las emociones se heredan, pero también se pueden transformar
El desarrollo saludable de la personalidad puede verse gravemente alterado por experiencias adversas tempranas. Estas vivencias generan cambios epigenéticos y afectan la neuroplasticidad de manera perjudicial, manifestándose en síntomas emocionales, dificultades en las relaciones, patrones de comportamiento disfuncionales y una menor capacidad de adaptación (Lawson, 2023).
El impacto de estas experiencias no es uniforme, sino que varía según el momento en que ocurren, su naturaleza y su intensidad. Además, otros factores como la predisposición genética, el sexo, la nutrición y el nivel de apoyo social juegan un papel clave en la vulnerabilidad de cada individuo al desarrollo de trastornos psicológicos (Agorastos et al., 2018) (Fig. 2).
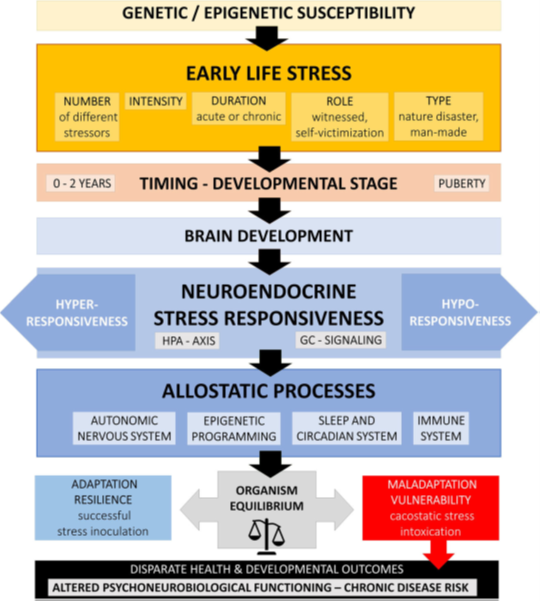
Fig. 2. Representación esquemática de los mecanismos neuroendocrinos que conducen a una desregulación prolongada del sistema de respuesta al estrés tras la exposición a experiencias adversas en la infancia (Agorastos et al., 2018). Esquema original en inglés.
Neuroplasticidad y Cambio Comportamental
El cerebro es moldeable. No somos prisioneros de nuestro pasado ni de las experiencias que nos dañaron. La adversidad deja huellas, pero el cerebro tiene la asombrosa capacidad de reorganizarse, adaptarse y sanar. Este proceso, conocido como neuroplasticidad, permite que las conexiones neuronales cambien a lo largo de la vida en respuesta a nuevas experiencias, aprendizajes y hábitos (Kolb & Gibb, 2011).
Cada vez que aprendemos algo nuevo o adoptamos un comportamiento diferente, se crean y fortalecen nuevas redes neuronales. Lo que repetimos, se refuerza; lo que dejamos de practicar, se debilita. Esto significa que podemos transformar nuestra manera de pensar, sentir y actuar con entrenamiento y constancia (Pascual-Leone et al., 2005). Existen estrategias que, basadas en la neurociencia, pueden ayudarnos a revertir los efectos de la adversidad y fomentar un desarrollo cerebral más saludable:
- Psicoterapia: Más que una conversación, la terapia genera cambios físicos en el cerebro. Se ha demostrado que la terapia cognitivo-conductual y las intervenciones basadas en la mentalización pueden inducir modificaciones estructurales en el córtex prefrontal y en el hipocampo, áreas clave en la regulación emocional y la memoria (Buchheim et al., 2012; de Lange et al., 2008). La psicoterapia no solo alivia síntomas, sino que reestructura el funcionamiento neuronal, permitiendo una mayor capacidad de afrontamiento ante el estrés y las emociones difíciles.
- Mindfulness y meditación: La práctica del mindfulness no es solo una moda, es una herramienta con respaldo científico. Estudios han demostrado que la meditación fortalece las conexiones en la corteza prefrontal y la amígdala, áreas esenciales en la regulación emocional y el autocontrol (Hölzel et al., 2010; Kaliman et al., 2014). La meditación no solo ayuda a reducir el estrés, sino que también modula la expresión genética relacionada con la inflamación y la resiliencia al trauma (Davidson & McEwen, 2012). Esto significa que practicar mindfulness puede tener un impacto directo en nuestra biología, mejorando la salud mental y física.
- Ejercicio físico: El movimiento transforma el cerebro. La actividad física regular no solo fortalece el cuerpo, sino que también incrementa la producción de factores neurotróficos, como el BDNF, que favorecen el crecimiento y la supervivencia de las neuronas (Erickson et al., 2011). Se ha observado que el ejercicio aeróbico mejora la memoria, la concentración y la regulación emocional, además de disminuir el riesgo de desarrollar trastornos depresivos y ansiosos (Hillman et al., 2008; Smith et al., 2010). En otras palabras, moverse más es una forma de cuidar la mente.
- Sueño de calidad: Dormir bien es una inversión en la salud cerebral. Durante el sueño profundo, el cerebro se reorganiza, elimina toxinas acumuladas durante el día y consolida la memoria (Gorgoni et al., 2013). La privación de sueño afecta la capacidad de aprendizaje, el equilibrio emocional y la neuroplasticidad. Se ha demostrado que una buena higiene del sueño no solo mejora el rendimiento cognitivo, sino que también reduce la vulnerabilidad a la ansiedad y la depresión (Murtagh & Greenwood, 1995).
Conclusiones
La neuroplasticidad nos recuerda que siempre hay margen para el cambio. No estamos condenados a repetir patrones dañinos ni a vivir bajo la sombra de la adversidad. Cambiar es posible cuando elegimos conscientemente qué experiencias alimentar en nuestro cerebro. Con el tiempo, las conexiones neuronales que refuerzan el malestar se debilitan y las que fomentan el bienestar se consolidan. La clave está en la práctica constante, en rodearnos de entornos saludables y en cultivar hábitos que nos ayuden a sanar y evolucionar.
Las experiencias adversas de la infancia pueden marcar nuestro destino, pero no lo determinan. Gracias a la neuroplasticidad y la epigenética, el cambio es posible.
Cada acción cuenta. Cada palabra, cada gesto de afecto, cada mirada comprensiva puede transformar una vida.
Referencias
Agorastos, A., et al. (2018). «Early life stress and trauma: developmental neuroendocrine aspects of prolonged stress system dysregulation.» Hormones (Athens) 17(4): 507-520.
Buchheim, A., et al. (2012). «Changes in prefrontal-limbic function in major depression after 15 months of long-term psychotherapy.» PLoS One 7(3): e33745.
de Lange, F. P., et al. (2008). «Increase in prefrontal cortical volume following cognitive behavioural therapy in patients with chronic fatigue syndrome.» Brain 131(Pt 8): 2172-2180.
Dumas, T. C. (2022). «Adult Health and Early Life Adversity: Behind the Curtains of Maternal Care Research.» Front Physiol 13: 804239.
Erickson, K. I., et al. (2011). «Exercise training increases size of hippocampus and improves memory.» Proc Natl Acad Sci U S A 108(7): 3017-3022.
Gorgoni, M., et al. (2013). «Is sleep essential for neural plasticity in humans, and how does it affect motor and cognitive recovery?» Neural Plast 2013: 103949.
Gräff, J., et al. (2011). «Epigenetic regulation of gene expression in physiological and pathological brain processes.» Physiol Rev 91(2): 603-649.
Heim, C. and C. B. Nemeroff (2001). «The role of childhood trauma in the neurobiology of mood and anxiety disorders: preclinical and clinical studies.» Biol Psychiatry 49(12): 1023-1039.
Hillman, C. H., et al. (2008). «Be smart, exercise your heart: exercise effects on brain and cognition.» Nat Rev Neurosci 9(1): 58-65.
Hölzel, B. K., et al. (2010). «Stress reduction correlates with structural changes in the amygdala.» Soc Cogn Affect Neurosci 5(1): 11-17.
Kaliman, P., et al. (2014). «Rapid changes in histone deacetylases and inflammatory gene expression in expert meditators.» Psychoneuroendocrinology 40: 96-107.
Lawson, W. M. (2023). «A Developmental Perspective of Psychopathology:
Adversity, epigenetics, and treatment implications.» Journal of the academy of medical Psychology. 67.
Malave, L., et al. (2022). «Early life adversity shapes neural circuit function during sensitive postnatal developmental periods.» Transl Psychiatry 12(1): 306.
McGowan, P. O., et al. (2009). «Epigenetic regulation of the glucocorticoid receptor in human brain associates with childhood abuse.» Nat Neurosci 12(3): 342-348.
Murtagh, D. R. and K. M. Greenwood (1995). «Identifying effective psychological treatments for insomnia: a meta-analysis.» J Consult Clin Psychol 63(1): 79-89.
Pilowsky, D. J., et al. (2008). «Children of depressed mothers 1 year after the initiation of maternal treatment: findings from the STAR*D-Child Study.» Am J Psychiatry 165(9): 1136-1147.
Smith, P. J., et al. (2010). «Aerobic exercise and neurocognitive performance: a meta-analytic review of randomized controlled trials.» Psychosom Med 72(3): 239-252.
Wickramaratne, P., et al. (2011). «Children of depressed mothers 1 year after remission of maternal depression: findings from the STAR*D-Child study.» Am J Psychiatry 168(6): 593-602.